На CROI представили последние данные по эффективности и безопасности фостемсавира

На минувшей неделе в Сиэтле появилась последняя информация об исследованиях фостемсавира – лекарственного средства для лечения ВИЧ-инфекции принципиально нового типа. Фостемсавир (FTR) — это первое в своем классе пролекарство ингибитора прикрепления темсавира (TMR). TMR связывается с ВИЧ-1, блокируя белок gp120, с помощью которого вирус присоединяется к рецептору CD4 и корецептору, находящимся на поверхности Т-лимфоцитов, и предотвращает заражение клетки.
На Конференции по ретровирусам и оппортунистическим инфекциям (CROI) был представлен постер с данными по исследованию 205889 (AI438011, NCT01384734), которое является условным наименованием недавно завершившегося КИ фазы 2b с использованием различных дозировок среди участников с ВИЧ-1, ранее проходивших лечение.
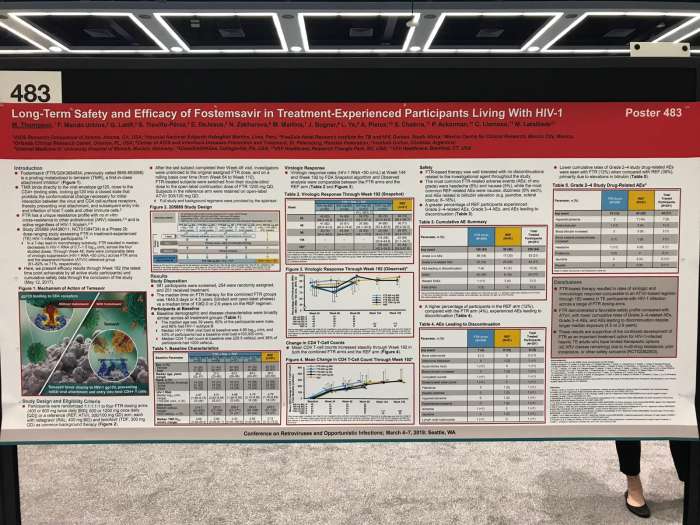
Разработчик опубликовал результаты по эффективности фостемсавира к 192-й неделе и общие данные по безопасности препарата.
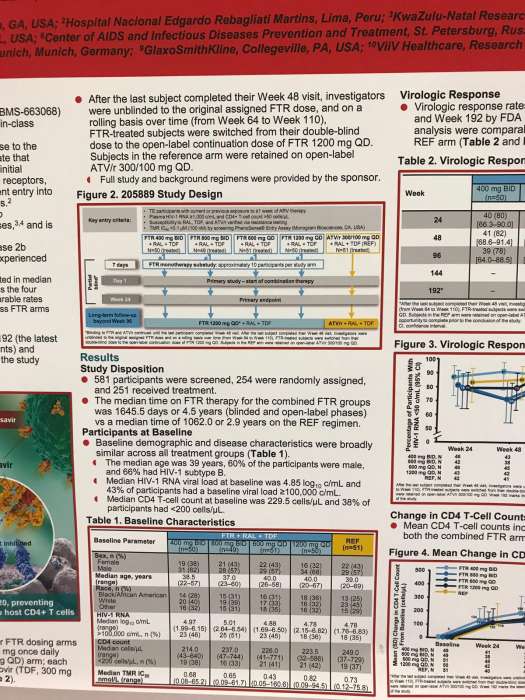
В представленных исследованиях принимали участие свыше 250 взрослых пациентов, 200 из которых были случайным образом разделены на 4 группы FTR в зависимости от дозировки препарата. Им предлагалось принимать по 400 или 800 мг средства два раза в день, либо по 600 или 1200 мг раз в день. Референс-группа (REF) включила 51 участника. Последние принимали атазанавир/ритонавир [ATV / r] 300/100 мг, ралтегравир (RAL, 400 мг два раза в день) и тенофовир (TDF, 300 мг).

По условиям исследования после промежуточного анализа на 48 неделе те, кто был рандомизирован в FTR, переключались на FTR с открытой меткой при 1200 мг в день с ралтегравиром и тенофовиром. Участники REF остались на ATV / r + RAL + TDF.
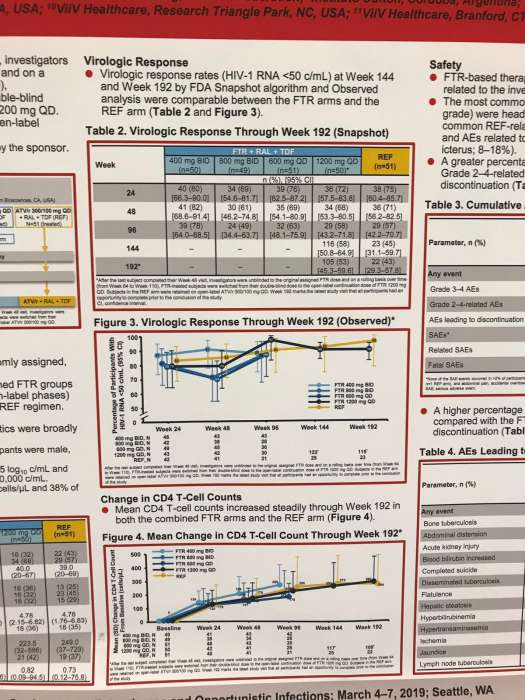
Среднее время нахождения пациентов на FTR составило 4,5 года (максимум 5,6), а для REF – 2,9 года. Показатели вирусологического подавления (РНК ВИЧ-1 <50 коп / мл) и среднего повышения количества CD4 (+279,9 и +263,7 клеток / мкл) между FTR и REF до 192 недели оказались сопоставимы.
Большинство побочных явлений были слабовыраженными и несистематическими. Однако в REF группе неблагоприятные реакции 2-4 степени или 3-4 степени встречались чаще, чем в FTR (39% против 12%; 33% против 18% соответственно). Также в группе FTR было меньше тех, кто решил прекратить лечение из-за побочных явлений (4% против 12% для REF), причем ни один из участников не прекратил прием терапии по причинам, связанным с FTR. Наиболее распространенными реакциями, связанными с исследуемым препаратом, были головная боль и тошнота.
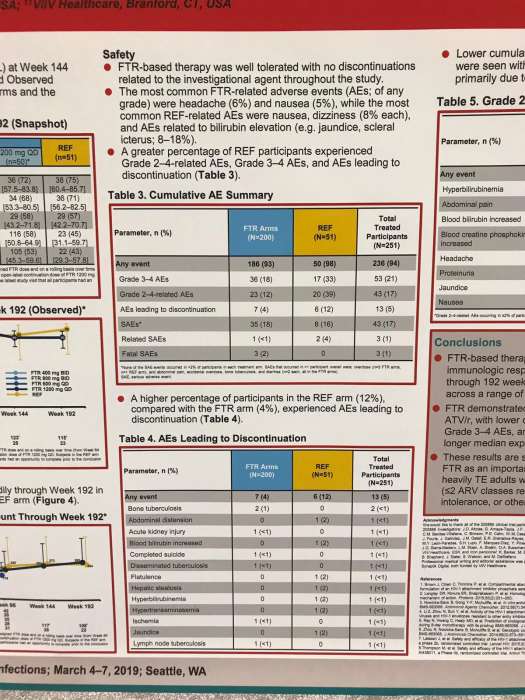
Таким образом, по предварительным оценкам, комбинация FTR с RAL + TDF продемонстрировала высокую безопасность, сопоставимую со схемой ATV / r с RAL + TDF. При этом в группе FTR было зафиксировано меньше побочных явлений, относящихся к 2-4 классам, а также неблагоприятных реакций 3-4 классов, приводящих к прекращению лечения.
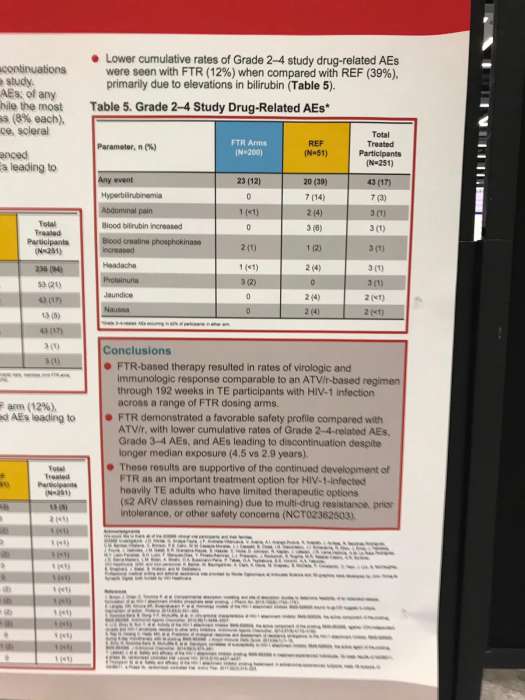
Кроме того, несмотря на более длительное медианное воздействие (4,5 против 2,9 года), к 192 неделе у FTR группы были сопоставимые с ATV / r показатели вирусологического подавления.
Эти результаты подтверждают текущую оценку FTR, проходящего в настоящий момент III фазу клинических исследований среди взрослых пациентов с ограниченными терапевтическими возможностями лечения (≤2 оставшихся классов АРВТ) из-за резистентности, проблем переносимости или противопоказаний (NCT02362503).



